普通化妆品备案资料常见问题官方辅导汇编
普通化妆品备案资料整理作为产品上市前的最后一个环节,在5个工作日资料整理中发现产品存在合规性问题,备案管理部门可以责令备案人改正,并在符合要求后再向社会公布备案信息。
在投入大量广告资源后,如果因合规性问题再被要求暂停销售或取消备案,不但会给企业造成较大的经济影响,也会对企业品牌和产品口碑带来负面效应。企业希望监管部门把问题尽可能在资料整理阶段出具,减少备案后暂停销售对企业生产经营造成的影响。
为了进一步提升备案资料整理阶段的问题发现能力,尽可能将问题解决在产品上市之前,器审中心组织资深检查员梳理资料整理阶段的常见错题,并结合实际案例,全面剖析不同类型“错题”的表现形式、所导致的审查问题和整改要求,帮助检查员更准确地把握审查要点,统一市区两级备案检查尺度。
以下是本次培训课件的汇总整理,从“是不是”、“有没有”、“对不对”等方面帮助大家更好地理解备案要求,避开申报“雷区”,提升备案资料整理质量,减少提交后不必要的补正!
今天给大家带来的错题类型是“有没有”:
错题1 备案申请表项下未上传注销再次备案说明文件。

小编提示《化妆品注册备案资料管理规定》第五十九条规定,普通产品注销后再次备案时,应当提交情况说明。
错题2 产品标签中上传的销售包装图片无法查阅。

小编提示 请企业在点击提交之前,务必确认相关备案资料是否已成功上传系统。
错题3 产品变更延长使用期限,未提交产品的稳定性研究资料。

小编提示《化妆品注册备案资料管理规定》第四十三条规定,涉及产品使用期限延长的,应当提交拟变更产品的稳定性研究资料。
错题4 变更生产工艺,未提交变更后产品的微生物和理化检验报告。

小编提示《化妆品注册备案资料管理规定》第四十三条规定,涉及生产工艺简述变化的,应当提交发生变更的情况说明,并提交拟变更产品的微生物和理化检验报告。
错题5 产品执行的标准中pH指标为:3.50-4.50,未提供人体试用试验安全性评价报告。

小编提示《化妆品注册和备案检验工作规范》规定,驻留类产品理化检验结果pH≤3.5或企业标准中设定pH≤3.5的产品应当进行人体试用试验安全性评价。
错题6 淋洗产品功效宣称含“祛痘”,未提供人体试用试验安全性评价。

小编提示《化妆品注册和备案检验工作规范》规定,宣称祛痘、抗皱、祛斑等功效的淋洗产品应当进行人体试用试验安全性评价。
错题7 多个生产企业生产同一产品,仅提供其中一个生产企业样品完整的检验报告,未提交其他生产企业样品的微生物与理化检验报告。
小编提示《化妆品注册备案资料管理规定》第三十三条规定,多个生产企业生产同一产品的,应当提供其中一个生产企业样品完整的产品检验报告,并提交其他生产企业样品的微生物与理化检验报告。
错题8 使用贴、膜类载体材料的产品未勾选“是否膜质载体材料”,未提供其来源、制备工艺、质量控制指标等资料。
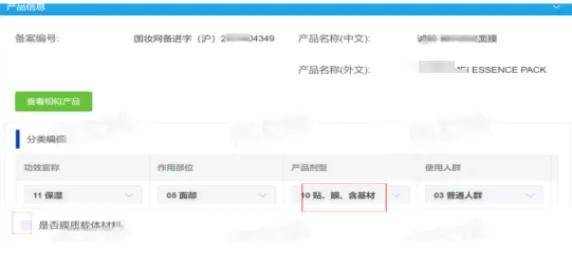
小编提示《化妆品注册备案资料管理规定》第三十三条规定,使用贴、膜类载体材料的,应当在备注栏内注明主要载体材料的材质组成,同时提供其来源、制备工艺、质量控制指标等资料。
(来源:上海器审|编发:天健华成化妆品注册部)
相关文章:
- [常见问题]中检院|化妆品审评最新常见问题解答
- [常见问题]普通化妆品备案问答(七十九期)|《<国际化妆品安全评估数据索引>收录的部分原料使用信息》问答增订版
- [常见问题]普通化妆品备案常见入门问题汇总
- [常见问题]普通化妆品备案需要提交哪些备案资料
- [常见问题]普通化妆品备案年度报告时间节点和产品范围
- [常见问题]【答疑解惑】化妆品安全评估——你“提问”我“答疑”
- [常见问题]“化妆品完整版安全评估”专版第8期
- [常见问题]普通化妆品备案常见问题一问一答(第四十四期)(化妆品安全评估专刊)
- [常见问题]广东省国产牙膏备案问题解答(八)
- [常见问题]江苏药监局审评中心化妆品备案注册你问我答问题汇总(2025年1季度)
相关推荐:
- [审批动态]2021年11月19日保健食品批件(决定书)待领取信息-1
- [审批动态]2022年03月23日化妆品决定书邮寄详情单
- [审批动态]2021年11月10日保健食品批件(决定书)待领取信息-1
- [审批动态]2024年01月17日化妆品注册批准证明文件送达信息发布
- [常见问题]如何以“拟备案品种”获取保健食品生产许可资质?|保健食品生产许可申报常见问题解答
- [常见问题]保健食品注册申报时研发报告(生产工艺部分)应提供哪些资料?
- [常见问题]普通化妆品备案问答(50期)|化妆品检测项目及人体安全性试用试验
- [申报资讯]推进保健食品注册备案双轨制,《保健食品原料目录与保健功能目录管理办法》发布
- [申报攻略]儿童化妆品申报与审评指南
- [申报资讯]国家市监总局食品审评中心关于调整受理大厅疫情防控要求的通知
-
86-010-84828041/42
400-6167-168
zhuceabc@zhuceabc.com
咨询微信:
13601366497(化妆品类)
1801335159(特殊食品类)











