“双无”保健食品换证流程及常见问题汇总
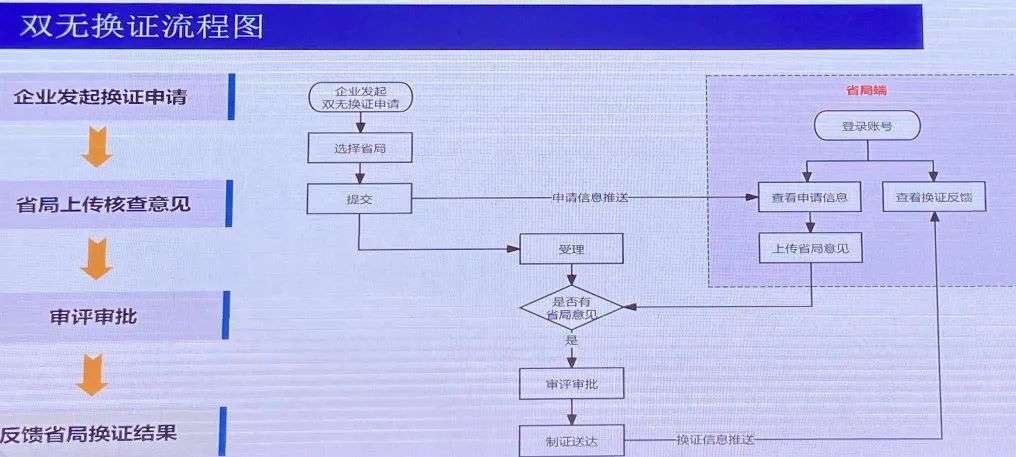
1.“双无”保健食品换证流程
2.目前企业信用系统显示申请人主体资质异常,是否可以申请换证?
答:不影响受理。但是,建议尽快将企业状态恢复正常,否则技术审评结束后,无法报批。
3.委托生产的产品,之前曾在多个省份或多家企业接受委托,是否需要所有省份的换证意见?
答:至少一家核发生产许可的省级市场监管部门出具意见,向合法生产许可的省局提出。
4.“双无”产品批件未载明所有的原辅料、未载明工艺?
答:当时的批件只载明主要原料,简单生产工艺。“双无”换证根据省局换证意见核实的实际生产执行的配方、工艺等进行技术审查。
5.双无产品配方调整可以主动替换或去除原料吗?
答:注册人按照现行规定调整产品配方(含替换或去除原料)的,按照现行新产品注册要求提交产品配方、生产工艺、标签说明书样稿、产品技术要求等研发材料,安全性、保健功能、卫生学、稳定性、功效成分/标志性成分检测等试验报告,论证产品的安全性、保健功能和质量可控性。替换或去除原料的,按新产品的申报要求和变更(换证)程序,进行受理审评。
6.申请换证是需要先去省局沟通还是先在国家局申请?
答:建议省局换证意见出具后,再提交换证申请。
7.原料不在原料目录的营养素补充剂是否在换证范围?
答:《换证审查要点》“五、具体要求(四)”使用保健食品原料目录内原料的,若符合备案要求,确认原注册人身份后,转备案管理。
8.历史遗漏问题出现申报资料与备案资料不一致问题,变更以何为依据?
答:换证审查绝对不支持“洗白”行为。审查中,发现资料造假,未按照注册配方工艺生产等行为,将核实后报总局处置。
9.更换配方原料后,如调整产品名称的,能否在新的产品名称后括号内标注产品原名称?
答:《换证审查要点》“五、具体要求(二)”,保留产品原名称的,理由应当充分合理。调整产品名称的,可在新的产品名称后括号内标注原名称,使用至本次换证证书有效期结束。
10.实际生产工艺会要求与原申报工艺完全一致,如原申报资料一些具体参数没有明确,增补后是否要补研究数据,以及功能毒理试验?
答:《换证审查要点》“五、具体要求(七)”,根据注册人的申请,省级市场监管部门出具的换证意见,审评机构按照现行规定将原辅料、生产工序及关键工艺参数、原料关联审查信息等内容纳入注册证书附件产品技术要求。
备注:换证申请的产品,是在产产品,省局换证意见提供产品实际生产工艺。原则上,不存在这类“按已经产生的结果,再去附和原因的”情况。绝对不支持“洗白”行为。
11.批文上的用量是一个范围,如1-2g/天,是怎么规范?
答:按照《保健食品注册申请服务指南》5.2.7项,标签说明书【食用量及食用方法】应与产品配方配伍及用量的科学依据、安全性和保健功能试验评价材料等相符。
12.原申报时多剂型产品中副剂型产品,在双无换证中是否需要补做毒理/功能实验?
答:《换证审查要点》“五、具体要求(七)”,同一产品包含多个剂型或食品形态的,若不影响产品质量安全,维持原批准的产品剂型或食品形态。同时,对于安全性评估,按照《换证审查要点》五,具体要求(五)执行。
13.一种新原料的安全评价是只做原料,还是只做产品,还是都做?
答:《换证审查要点》“五、具体要求(五)”,产品配方中含有保健食品新原料的,若原注册时未提供原料安全性评价材料,也无法提供真实、可信、可溯源的上市后人群食用安全性评价报告,应当按照《保健食品及其原料安全性毒理学检验与评价技术指导原则(2020年版)》(以下简称指导原则)要求进行新原料及产品的安全性评价及关联审查。产品中含有2个及以上保健食品新原料的,还应当按照《指导原则》开展产品90天经口毒性试验和致畸试验,并结合新原料食用历史、使用情况、产品上市后人群食用安全性评价报告等综合评估产品长期食用的安全性。
14.标准可能需要调整,原标准制定不合理,系统填写技术要求是变更前还是变更后?
答:《换证审查要点》“五、具体要求(七)”,注册人应当在备案或主动公开的执行企业标准基础上,研究制定符合现行规定和国家标准的技术要求。
15.如果需要调整配方工艺,如何调整?
答:可以参考审评中心网站关于“保健食品换证常见问题及解答”。
16.批件上的原料现在是否面临安全性问题?
答:调整配方,参考《换证审查要点》“五(八)”;如不确定,《换证审查要点》“五、具体要求(五)”
17.增强免疫力功能能否不再补做,因为费用太高!
答:参考《新版功能目录》解读文件。
18.产品原名称建议保留?
答:参考《换证审查要点》“五、具体要求(二)”。
19.新原料定义是什么?
答:《保健食品注册审评审批工作细则》3.4.2.2.1,保健食品新原料包括:(1)普通食品、新食品原料、“按照传统既是食品又是中药材的物质”和“拟纳入保健食品原料目录”以外的原料;
(2)普通食品、新食品原料、“按照传统既是食品又是中药材的物质”和“拟纳入保健食品原料目录”中的物品,采用导致物质基础发生重大改变的工艺生产的原料。
20.产品功效成分指标:重新研究后下调,可按下调后制定和变更?
答:《保健食品注册申请服务指南》8.2,变更申请事项应仅限批准证书及其附件载明的内容,且不得导致产品质量发生实质性改变。
21.如何理解卫法监发(2002)51号文中“如使用附件1、2之外的动植物物品,个数不得超过4个;使用附件1和附件2之外的动植物物品或(原料),个数不得超过1个”这两句话的关系,是必须同时满足,还是满足其中一个即可?
答:这是一句话,同时满足。
22.因为历史问题,有些品种在此次换证过程可能需要大量资金和时间去做很多补充研究,特别是配方调整,企业需要按照现行新产品要求重新论证安全性和保健功能和质量可控。中心能否针对此类情形,开设提前沟通渠道,将审评向前段延伸,组织专家提前介入,为后续审评审批扫清障碍?
答:配方调整,按照新产品准备全套资料。
23.2022年8月2日,食品审评中心再次发布“卫生部关于进一步规范保健食品原料管理的通知(卫法监发(2002)51号)”,51号文中附件1既是食品又是药品的物品名单,共有87种药食同源的物质。国家卫生健康委员会同国家市场总局分别于2019年11月25日公告将当归、山奈、西红花、草果、姜黄、荜茇6种物质;2023年11月9日公告将党参、肉苁蓉、铁皮石斛、西洋参、黄芪、灵芝、山茱萸、天麻。杜仲叶9种物质;2024年8月12日公告将地黄、麦冬、天冬、化橘红4种物质纳入按照传统既是食品又是中药材的物质目录管理,是否可以理解后纳入按照传统既是食品又是中药材的物质目录管理的19种物质属于附件1既是食品又是药品的物品名单?
答:首先指出,食品审评中心没有再次发布卫法监发(2002)51号的权限,中心外网是全文转登,对于问题,初步意见两种情况:当归、山奈、西红花、草果、姜黄、荜茇6种物质,卫健委公告“仅作为香辛料和调味品”,这个问题需要组织讨论明确;其他13种,原则上视为新增的食药物质。具体建议,“双无”换证是变更申请,按实际生产的配方工艺等技术要求提出申请。
24.关于换证期限:是5年换证期限到后企业必须完成上市“双无”产品换证,必须获得新批件?还是到期后只要企业提交了申请资料,尚未完成审评并获得新证也还可以继续生产?
答:建议提早申报。
25.技术要求:复方产品是否增补质控指标?
答:《换证审查要点》“五、具体要求(七)”,注册人应当在备案或主动公开的执行企业标准基础上,研究制定符合现行规定和国家标准的产品技术要求。涉及增订、修订理化、微生物、功效成分/标志形成指标的,还需要提交修订说明以及相应的卫生学、稳定性、功效成分/标志性成分检测等试验报告等材料。
26.由于历史原因,原配方研究时香精为“食用香精”,后期由于市场需求,在原薄荷味基础上又开发了西瓜味和话梅味两款产品(配方其它原料完全相同),总共有三个口味,目前产品也上市20多年,消费者遍及全国,公司在产品功效和安全性方面也积累了较多的人体试食数据。虽与现行法规有不一致之处,想咨询总局专家,在产品换证审批时,考虑到历史遗留问题,如能补齐各口味产品安全评价、稳定性等资料后,能否保留原该产品的三个口味,即换发三个保健食品文号。
答:建议在确定一个口味产品的基础上,参照《保健食品申报与审评补充规定(试行)》关于“保健食品原料与主要辅料相同,涉及不同口味、不同颜色的产品”提出其它两个口味产品的注册申请。
27.成品指标以及工艺是否按在产工艺申报,原始申报材料遗失?
答:省级局换证意见。
28.有关注册申报系统填报的问题,产品配方:系统提示需确保与原批件一致。问题:我们是益生菌产品,现行批件没有菌株号,按现行规定益生菌保健食品填报配方时需写上菌株号,请问系统填写配方时是否需写菌株号?
答:《益生菌类保健食品申报与审评规定(试行)》第六条,申请益生菌类保健食品,除按保健食品注册管理有关规定提交申报资料外,还应提供以下资料:(一)产品配方及配方依据中应包括确定的菌种属名、种名及菌株号…
29.关于现行规定修订技术要求的,如申请人自查需要增订/修订某个指标,比如需要增订“水分”指标,稳定性试验请问是只做“水分”,还是产品其它指标都需一起做稳定性考察?
答:换证审查要点》“五、具体要求(七)”,注册人应当在备案或主动公开的执行企业标准基础上,研究制定符合现行规定和国家标准的产品技术要求。涉及增订、修订理化、微生物、功效成分/标志形成指标的,还需要提交修订说明以及相应的卫生学、稳定性、功效成分/标志性成分检测等试验报告等材料。
30.关于产品实际工艺可能被认为不符合现行生产许可要求的问题:原产品是胶囊剂型,内容物是供应商已经混好的混合粉,申请人购入混合粉之后只进行填充胶囊和包装。请问这种情况在换证时,是否需要提出变更工艺的申请,即申请人自行购买各个原辅料,自行混合再装胶囊
答:省局换证意见包括实际生产执行的配方、工艺及技术要求。生产许可涉及违反《食品安全法》及其实施条例、《保健食品生产许可审查细则》等规定,“换证”工作无法开展的,原则报总局处置。
31.关于“产品长期食用的安全性论证报告”。
答:《换证审查要点》附件3,产品上市后食用安全性报告,是指参照现行延续注册要求,由注册人(证书持有人)法人代表或授权签字人签字确认的,产品上市销售后开展的质量安全性投诉处置以及情况收集、处理过程结果等情况汇总报告以及产品上市销售过程中是否涉及安全性问题的结论性承诺。
《换证审查要点》附件2,产品上市后食用安全性报告,涉及需要对产品配方中原辅料进行再确认情形的,还应当相应提交产品长期食用的安全性论证报告(包括产品配方配伍和用量的理论依据、文献依据等)、保健食品新原料安全性评价材料等。
32.产品配方是提取物,工艺是药材投料提取,换证的话参考实际工艺?或者可否修改?
答:省局换证意见包括实际生产执行的配方、工艺等技术要求。生产许可涉及违反《食品安全法》及其实施条例、《保健食品生产许可审查细则》等规定,“换证”工作无法开展的,原则上报总局处置。
33.总固体检测方法引用问题:《药典》酒剂要求测总固体,总固体指标的检测方法是否可以引用国家标准,如GB/T13662-2018《黄酒》中的非糖固形物。《药典》中的固形物含量检测方法存在可操作性差、检测结果差异大的问题
答:总固体指标来源于药典中的酒剂要求,而且药典有明确的方法,建议执行药典方法。国标里说的都是固形物,跟总固体内涵相似,但方法不同。
34.总黄铜检测方法引用问题:理化指标的含量检测方法是否一定要执行《保健食品检验与评价技术规范》?《保健食品检验与评价技术规范》中总黄酮的含量检测需要使用甲苯洗脱,2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,甲苯在3类致癌物清单中,出于试验安全的考虑,能否考虑用企业标准执行
答:《保健食品理化及卫生指标检验与评价技术指导原则(2020年版)》总则,本指导原则第二部分提供的检测方法为推荐方法,注册申请人在对产品功效成分/标志性成分检测时,应选择适合相应产品的检测方法,申请注册检验时,应提供该产品的配方、工艺、产品技术要求及功效成分/标志性成分检测方法以及检测方法的适用性、重现性等方法学研究材料。检测方法应科学、适用、重现。
35.原技术要求指标检测方法列全文的是否开展方法学?
答:企业应确保检测方法适用、重现,以免监督抽检、风险,职业打假时出现纠纷。
36.原批文未记载规格内容,当前在售的主力规格有125ml/瓶、258ml/瓶等多个规格,又有玻璃材质、塑料材质。对于多种规格、包装材质,如果都想保留,企业无法确认要针对规格+材质的组合逐一开展稳定性试验
答:省级局换证意见明确实际生产情况。
37.关于原批件保质期为36个月的产品,如何实施稳定性试验的问题:按照现行保健食品稳定性试验指导原则,超过24个月保质期的产品应采取长期留样模式开展稳定性试验,企业时间层面的压力较大(距离2028年只剩3年多时间)。是否能够考虑先开展一年留样试验,再用该样品开展3个月加速试验,可以缩短一半的稳定性试验时间,这一模式能否获得认可?或者有没有其它可以缩短试验周期的稳定性试验方案
答:“先开展一年留样,再用该样品开展3个月加速试验,从而推出产品保质期3年”不符合稳定性试验指导原则,如涉及增订指标而需调整保质期或开展稳定性试验,建议开展加速试验,及早申报换证。同步开展长期保存试验,数据完备后再申请延长保质期。
38.之前产品规格是100ml、150ml,企业希望2个规格都保存下来,怎么申请?
答:省级局换证意见明确实际生产情况。
39.没有国标、地标或行标的物料,但属于地方常用食材,换证时是否可以继续使用?如酸梅、余甘子、山葡萄等南方水果。如果可以,其质量标准能否写成“应质好、无病虫害、无霉变、无杂质,并符合GB2762、GB2763的规定”?还是列表展开?如果不可以,希望能够明确,否则换证时可能会出现重做功能试验等情况,给企业造成较大经济损失。
答:省级换证意见明确实际生产情况。中心外网问答《保健食品产品技术要求常见问题及注意事项》,原辅料质量要求应引用具有专属性的质量标准,而非通用标准或使用标准。若无相关标准,应参考《保健食品注册申请服务指南》5.2.2.4(5)制定。例如:苹果粉不应引用GB/T 29602《固体饮料》,大豆油不应引用GB 2716《植物油》,某食品添加剂不应引用GB 2760《食品添加剂使用标准》,复配原料不应引用GB 26687《食品安全国家标准复配食品添加剂通则(含第1号修改单)》
40.双无换证审评意见是3个月的补证时间吗?建议放宽。
答:执行《保健食品注册与备案管理办法》。
41.功能性食品中的营养素限量,是否完全按照现行规定按照最低值等于标签标识。考虑产品上市多年,消费者无法理解法规变化引起标签改变,建议尽可能不做改变,此种情形维持现有标识和标准限值?
答:《保健食品注册申请服务指南》5.2.7项,标签说明书【功效成分或标志性成分含量】应包括成分名称及含量。应与产品技术要求中功效成分或标志性成分指标名称一致,以产品技术要求中指标最低值为标签说明书标示值。
42.换证目的是让产品符合现行规定,按实际执行的配方、工艺和技术要求生产吧?而大部分省局以原申报资料作为办理生产许可证的前提,这可能导致企业只能按原申报资料中的配方、工艺等进行换证?
答:省级局换证意见明确实际生产情况。
43.注册人按照要求直接提出换证申请,已受托生产企业也可以申请换证,有什么不同要求?现场核查按照新规范要求执行还是可以简化程序?
答:注册证书所有权与受托生产企业无关,应当由注册人申请换证,对资料存疑等情形,不排除开展有因核查、注册核查等措施。
44.老批文、在工艺、执行标准,相比目前的技术和工艺,显得不适用,换证过程中是不是可以按照新技术来,但和原批件工艺有差异,会不会受影响?
答:省局换证意见明确实际生产情况,对于工艺,换证后核发《产品技术要求》将纳入主要工序和关键工艺及参数,需要变更工艺,建议换证后申请变更。
45.“双无”换证审评审批工作,换证申请人确保提交的申请材料与之相符,怎么衔接好“双无”换证申请与省局出具换证意见相关环节,具体时间和条件?
答:建议省级局换证意见已经出具后,再提交换证申请,请认真核对申报资料,确保前后相符。
46.产品名称咨询:早年行业对硬质糖果普遍采用拉条成型工艺,因而以“含片”命名的清咽硬质糖果类保健食品,普遍存在“溶化性”和“重量差异”两项指标达不到现行“含片”规定,我们也查到一些清咽同类产品在延续注册时,审评专家可能考虑历史原因,继续保留“含片”名称,没有强制性要求改成“XX糖”。我们建议换证时,审评专家能否也考虑到企业多年市场培育,继续保留原名称?
答:可按《审查要点》申请保留原名称。
47.拟定的产品技术要求与企标一致时,是否要提供产品全项目稳定性检测报告等作为?
答:注册人应当在备案或主动公开的执行企业标准基础上,研究制定符合现行规定和国家标准的产品技术要求。涉及增订、修订理化、微生物、功效成分/标志形成指标的,还需要提交修订说明以及相应的卫生学、稳定性、功效成分/标志性成分检测等试验报告等材料。
48.产品技术要求增订指标的,是只需要提供该指标的稳定性试验,还是提供所有指标稳定性试验?
答:建议参照《保健食品注册申请服务指南(2016年版)》产品稳定性重点考察指标和非稳定性重点考察指标,以及注册申请材料等相关要求。例如:增订功效成分或标志性成分指标的,应当参照《指南》5.2.2.4(3)详细说明该功效成分或标志性成分指标选择、指标值制定及其检测方法研究验证的过程和依据,提供研究报告,以及三批样品拟增订功效成分或标志性成分的稳定性试验报告。(来源:国家市监局食品审评中心|编发:北京天健华成保健食品注册部)
相关文章:
- [常见问题]使用有机溶剂提取、纯化、酶解、发酵、合成、破壁等特定前处理工艺的原料申报保健食品,有哪些注意事项和审评要求?
- [常见问题]原料已纳入保健食品原料目录,产品原料每日用量超出保健食品原料目录规定的范围,这类产品如何进行注册或备案?
- [常见问题]原料已纳入保健食品原料目录,但产品声称的保健功能不在可备案范围的,这类产品如何注册或备案?
- [常见问题]已批准注册产品中,原料已纳入保健食品原料目录,但产品剂型形态不在可备案范围的,这类产品如何注册或备案?
- [常见问题]申报含蒽醌类成分原料的保健食品新产品应注意哪些问题?
- [常见问题]“双无”保健食品换证常见问题及解答(第一批)
- [常见问题]科普|申报保健食品注册备案不可不知的基本问题
- [常见问题]广东省市监局|保健食品注册备案及生产经营常见问题咨询解答
- [常见问题]保健食品广告能否声称或者暗示广告商品为保障健康所必需?
- [常见问题]保健食品复合配料在配料表中如何标示?
相关推荐:
- [审批动态]2024年2月29日保健食品注册批件(决定书)待领取信息-1
- [申报资讯]义乌、辽宁首个进口非特殊用途化妆品备案凭证分别发放
- [常见问题]进口化妆品备案和注册申报时境内责任人授权书需要载明哪些内容?
- [常见问题]进口&国产化妆品注册和备案检验信息管理系统使用问答
- [审批动态]2023年11月13日化妆品注册批准证明文件送达信息发布
- [审批动态]2022年06月16日化妆品不予批准决定书邮寄详情单
- [材料要求]防晒化妆品SPF值测定和标识有关申报材料
- [申报资讯]《化妆品注册人、备案人化妆品不良反应收集和报告指导原则(试行)》征求意见
- [审批动态]2022年04月26日化妆品批准证明文件邮寄详情单
- [申报讲堂]进口化妆品备案申报知识小讲堂
-
86-010-84828041/42
400-6167-168
zhuceabc@zhuceabc.com
咨询微信:
13601366497(化妆品类)
1801335159(特殊食品类)











